


DNA-free PCR Master Mixy
DNA-free PCR Master Mixy s trehalózou a 1,2-propandiolem
DNA byla odstraněna z Master Mixů novou enzymatickou metodou využívající rozvolnění komplexů DNA a Taq DNA polymerázy (patent v přípravě). Absence DNA, která kontaminuje všechny preparáty DNA polymeráz a všechny námi testované komerční Master Mixy, předurčuje tyto nové DNA-free Master Mixy k využití jako nový nástroj pro stanovení bakteriálních a kvasinkových kontaminací a DNA analýzy. Přítomnost trehalózy a 1,2-propandiolu (TP) v reakční směsi napomáhá amplifikaci obtížně analyzovatelných vzorků, včetně DNA se zvýšeným obsahem GC a vzorků, které obsahují inhibitory PCR (Horáková a spol., BMC Biotechnology, 11:41, 2011). Master Mixy mohou navíc obsahovat anti-Taq monoklonální protilátku pro hot-start (HS) PCR anebo fluorescenční interkalační barvivo SYBR Green I (SYBR). Konkrétně se jedná o tyto Master Mixy:
TP HS DNA-free 2x Master Mix
- pro hot-start PCR a hot-start qPCR se specifickou sondou,
TP HS DNA-free 2x SYBR Master Mix
- pro hot-start qPCR s využitím fluorescenčního barviva SYBR Green I.
V případě požadavku je možná variace těchto produktů, kdy např. barvivo SYBR Green I je nahrazeno SYTO-9.
Příklad amplifikace bakteriální DNA s využitím TP HS DNA-free 2x SYBR Master Mixu
Materiál a metody
Pro amplifikaci byla použita bakteriální DNA připravena z přesnoční kultury E. coli pomocí DNA extrakčního kitu DEP-25 (Top-Bio, Kat. č. D225). Pro amplifikaci fragmentu DNA kódující bakteriální 16S rRNA byla použita dvojice primerů, „forward“ (5`-CCTACGGGAGGCAGCAG -3’; Muyzer a spol., Appl. Env. Microbiol., 695-700, 1993) a „reverse“ (5`- TGGACTACCAGGGTATCTAA-3’; Pentimalli a spol., RCCV, 26-31, 2008). Veškeré manipulace byly prováděny za sterilních podmínek s využitím DNA/RNA UV dekontaminačních boxů UVT-S-AR (Biosan, Ltd). Pro qPCR byl použit Rotor-Gene Q (Qiagen) s následujícími cyklačními parametry: počáteční denaturace (94°C, 2 min), 50 cyklů zahrnujících denaturaci (94°C, 15 s), nasedání primerů (55°C, 15 s) a extenzi (72°C, 45 s). Na závěr byla provedena analýza teplot tání amplifikované DNA v rozmezí 72°C - 95°C a analýza velikosti DNA amplikonů elektroforézou v gelu 1% agarózy (Top-Bio, Kat. č. P045) s ethidium bromidem (1 µg/ml; Top-Bio, Kat. č. P046).
Výsledky
Při použití dvojice primerů pro amplifikaci fragmentu DNA kódující 16S rRNA došlo ve vzorku s přídavkem bakteriální DNA k očekávané amplifikaci (Ct = 16,42 a 16,38), zatímco ve vzorcích bez externě přidané DNA k amplifikaci nedošlo (Ct > 50, Obr. 1A). Amplifikovaná DNA byla homogenní z hlediska teplot tání (Obr. 1B) a při elektroforetické analýze v agarózovém gelu měla odpovídající velikost 470 pb (Obr. 1C).
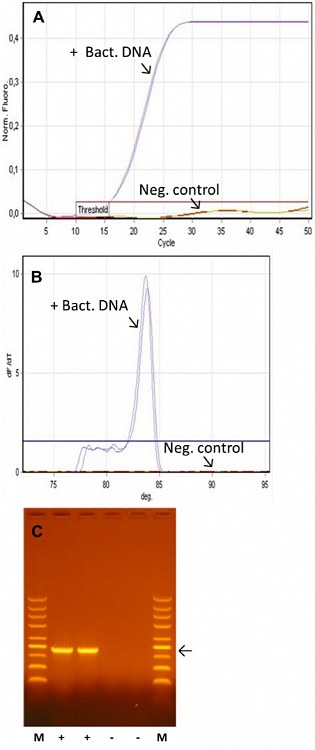
Obr. 1. Amplifikace fragmentu genu 16S rRNA ve vzorku s přidanou bakteriální DNA nebo v kontrolním vzorku bez externě přidané DNA s využitím TP HS DNA-free 2x SYBR Master Mixu.
(A) Dva vzorky s bakteriální DNA (~5 ng/zkumavku) nebo bez externě dodané DNA (Neg. control) byly amplifikovány pomocí dvojice primerů specifických pro 16S rRNA geny. Fluorescence SYBR Green I byla monitorována v průběhu qPCR a Ct hodnoty kalkulovány s využitím programu Rotor-Gene Q. Hladina „Threshold“ pro výpočet Ct hodnot je rovněž vyznačena. Po skončení qPCR byla provedena analýza teplot tání (B) a elektroforetická analýza v agarózovém gelu pro určení velikosti produkovaných DNA amplikonů (C). V obrázku C znamená M, DNA marker (Top-Bio, Kat. č. C150); +, vzorky s přídavkem bakteriální DNA; –, vzorky bez externě přidané DNA; šipka, pozici amplifikovaného fragmentu DNA pro 16S rRNA (470 bp).
Závěr
Při použití dvojice primerů specifických pro gen 16S rRNA a TP HS DNA-free 2x SYBR Master Mixu dochází k tvorbě DNA amplikonů pouze, pokud je dodána bakteriální DNA. Množství kontaminující bakteriální DNA je novou metodou přípravy Taq DNA polymerázy a Master Mixů významně sníženo.